平湖紅曲黃酒釀造過程中真菌菌群動態、紅曲霉生長抑制因素(二)
2結果與分析
2.1平湖紅曲黃酒釀造過程中優勢真菌菌群的變化
2.1.1優勢真菌菌群結構分析
以NS1/GCFung作為引物擴增平湖紅曲黃酒各個釀造時間點所提真菌基因組的18S rDNA序列可變區,所得PCR產物進行變性梯度凝膠電泳(DGGE)分析。
在DGGE圖譜(圖2)中,平湖紅曲(泳道Q01)檢測到一條高亮條帶(Band 2),而平湖紅曲黃酒釀造過程中具有處于不同位置的2個高亮條帶(Band 1和Band 2),說明Band 2對應的菌株在平湖紅曲中屬于優勢菌,并且Band 1對應的菌株也存在于平湖紅曲中,并非優勢菌,其提取效率低,因此Band 1在Q01泳道中條帶不明顯。
以純菌釀酒酵母NY02(Saccharomyces cere-visiae)及純菌紅曲霉B1(Monascus sp.)的DGGE條帶作為參照,發現Band 1和Band 2分別與兩純菌條帶處于同一位置,結合前期對平湖紅曲的真菌菌群結構分析,可以確定平湖紅曲黃酒釀造過程中的優勢真菌主要是釀酒酵母和紅曲霉,說明平湖紅曲在進行傳統釀造過程中,與其它黃酒體系相比,真菌體系較為簡單。
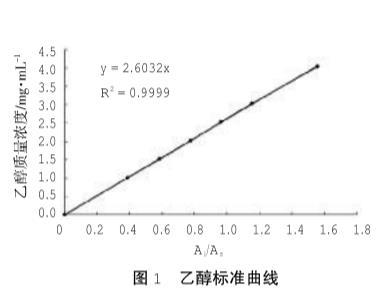
圖1乙醇標準曲線
此外,觀察釀造過程中的菌群動態變化,發酵前3 d,紅曲霉為絕對優勢菌,至發酵第4天后,酵母菌對應的條帶逐漸變亮,紅曲霉對應的條帶逐漸變暗,甚至幾乎消失,酵母逐漸取代紅曲霉作為釀酒的優勢菌,可能與釀造過程中的環境變化有關,也可能與兩者生長周期和生長能力不同有關。
通過DGGE的定性分析可知,平湖紅曲黃酒釀造過程中的優勢菌為紅曲霉和釀酒酵母,欲探知兩種優勢菌的菌群數量變化,還需結合實時熒光定量PCR技術對其進行定量追蹤。
2.1.2優勢真菌菌群數量變化
采用特異性引物Mp-F/Mp-R和SC1d/SC1r分別對平湖紅曲黃酒各個釀造時間點的紅曲霉和釀酒酵母菌量進行檢測,結果如圖3所示:兩種優勢菌的變化趨勢與DGGE結果相符,釀酒酵母在發酵前期基本檢測不到,到第2天之后迅速增加,至發酵第5天達到5.51log10CFU/g,之后呈現緩慢增加的趨勢。紅曲霉的數量變化則與之相反,發酵第一天則迅速下降至4.62log10CFU/g,之后在整個發酵過程中呈現緩慢下降趨勢,在發酵第10天后下降明顯。
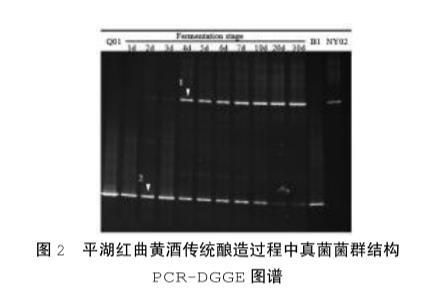
圖2平湖紅曲黃酒傳統釀造過程中真菌菌群結構PCR-DGGE圖譜
由于第0天和發酵過程中的取樣方法的差異可能導致發酵第1天的菌量迅速下降。第0天是對紅曲進行直接取樣處理,而整個發酵過程的取樣是對酒壇里的酒醅(曲米混合樣)進行取樣處理,樣品狀態不一致,對菌量測定結果有一定差異。然而,在發酵過程中,操作一致的情況下,紅曲霉的菌量仍然緩慢下降,釀酒酵母則穩步上升。針對紅曲霉菌量下降的可能原因有:(1)紅曲霉與釀酒酵母之間存在拮抗作用,釀酒酵母的生長抑制了紅曲霉菌量的增加。然而,有部分學者研究表明,上述兩種菌可以互利共棲,產生協同作用。Shin等研究表明紅曲霉與釀酒酵母純菌株混合培養時,紅曲霉的生物量會增加至原來的兩倍左右。周學勤等研究發現酵母菌的添加并不會影響紅曲霉生長曲線的基本模式,酵母菌及其細胞破碎液還可以提高紅曲霉的色素產量,因此二者相互抑制的可能性不大。(2)紅曲霉為好氧菌,由于傳統釀造過程中,從發酵第6天開始封罐壇,溶氧量的減少抑制了紅曲霉的生長。(3)紅曲米對紅曲霉的物理性束縛阻礙了紅曲霉的生長和釋放。紅曲本身是在蒸熟的大米上接種紅曲霉發酵制備而得,紅曲霉菌絲深入到曲米中,生長空間有限,則在發酵過程不易被釋放出來。(4)紅曲浸泡液中可能存在某些生長抑制因子,抑制了紅曲霉的生長。(5)發酵過程中乙醇含量迅速增加,超過了紅曲霉的耐受能力,導致紅曲霉的生長受到抑制。
基于此,試驗將采用小體系的研究方法對紅曲霉菌量減少的原因進行細化探究。在進行小體系探究時,除了發酵條件應與傳統釀造保持一致,還需要通過試驗說明紅曲霉能夠在小體系的糯米基質上生長,且小體系對于傳統發酵的模擬能夠重現紅曲霉的生長變化規律,這樣小體系的構建才有意義。
2.2.1模擬體系的構建
采用小體系研究方法,利用三角瓶替代傳統酒壇進行發酵,發酵過程中紅曲、糯米及水的比例均與酒壇釀造一致,糖化時間、密封時間、發酵溫度等均嚴格模擬傳統發酵。
模擬傳統體系與傳統發酵體系相比,雖然在物質傳遞、群體感應、菌株拮抗、容器滲氧效果等方面可能有所不同,但結合圖3、圖4可以發現,模擬傳統的紅曲霉菌量緩慢下降,與酒壇釀造的變化趨勢頗為相似,說明模擬傳統體系中紅曲霉的變化趨勢重現性較好,體系構建較為合理,便于后續研究。
2.2紅曲霉的生長抑制因素探究

另外,在純菌發酵體系中,紅曲霉的菌量逐步增加,說明紅曲霉可以依附于糯米基質上生長,并且第6、7天的封壇發酵對紅曲霉的生長抑制并不顯著,可見在封壇前期溶氧量的暫時減少并不是影響紅曲霉生長的關鍵因子,發酵體系內殘余的氧氣仍能促進紅曲霉的生長繁殖。
針對模擬傳統(混菌發酵)和純菌發酵體系中紅曲霉菌量變化的差異,以下將在小體系的基礎之上分別構造體系以尋找影響紅曲霉生長的關鍵因子。
2.2.2曲米的物理束縛對紅曲霉生長的影響體系
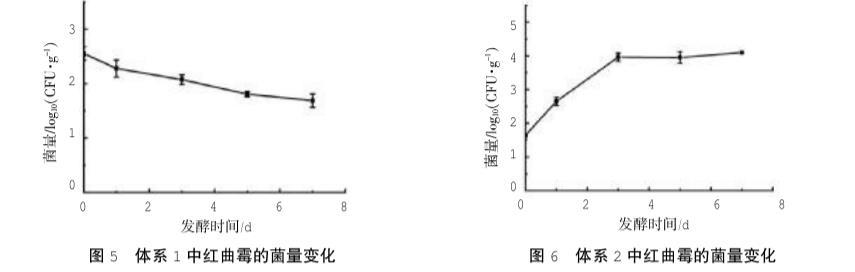
1是在模擬傳統的基礎之上,將紅曲米進行破碎,提取紅曲米中的菌株進行混菌發酵。解除了曲米的物理束縛后,紅曲霉的菌量仍然逐漸減少(圖5),說明曲米的物理狀態并不會對紅曲霉的生長起到明顯的抑制作用。這可能由于紅曲米在制備過程中,將糯米進行蒸煮后,有利于米粒中的游離水與淀粉發生反應,使其糊化,而在糊化過程中,水分子進入微晶結構,打破了淀粉分子之間的聯系,使淀粉分子通過水合過程形成膠體體系,該體系的硬度明顯降低,減少了曲米中微生物生長的機械阻礙。而曲米中的微生物在生長繁殖過程中,會降解糊化體系中的淀粉,拓寬了微生物的生長空間,干燥后使曲米形成多孔結構,減少了曲米的物理束縛,因而對紅曲霉生長的影響較不顯著。
2.2.3曲米浸泡液對紅曲霉生長的影響
在紅曲米的制備及貯存過程中,曲米內部和表面微生物分泌的代謝產物可能會對紅曲霉的生長產生影響,為探究此影響,構建了體系2。該體系在純菌發酵的基礎上加入了無菌紅曲處理液,如圖6所示。結果表明,體系2的生長曲線與圖4中的純菌發酵體系類似,紅曲霉的菌量穩步增加,可見曲米浸泡液中的物質在發酵過程中對紅曲霉的生長抑制并不顯著,可能由于微生物在生長過程中會通過代謝作用來改變生長環境,從而利于它自身的生長,而DEEG和qPCR的結果均顯示紅曲霉為紅曲米中的優勢菌,曲米中積累的物質難以對紅曲霉產生明顯的負面影響。
2.2.4酒精度對紅曲霉生長的影響
構建體系3,研究酒精度對紅曲霉生長的影響。如圖7所示,空白組(KB)和4%酒精度樣品組①的糯米上都能布滿菌絲,而隨著乙醇濃度的增加,糯米培養基上的紅色菌絲逐漸減少,表明酒精度的增加對紅曲霉的生長有明顯的抑制作用。

圖7體系3中不同酒精度下紅曲霉的生長情況
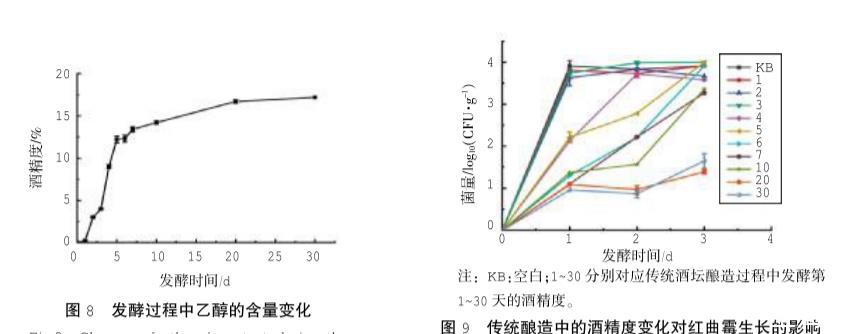
試驗進一步對傳統釀造過程中酒精度的變化與紅曲霉生長的關系進行細化研究。根據傳統酒壇釀造過程中酒精的變化情況(圖8),將各個取樣時間點對應體積分數的乙醇加入帶有紅曲霉C1孢子液的糯米培養基中,單獨發酵3 d,結果如圖9所示。
由圖9可知,單獨發酵第1天紅曲霉的菌量就出現明顯差異,分別聚集在3個位置:(1)KB和傳統發酵第1~3天的酒精度對應的紅曲霉菌量最多,且在后續發酵中基本持平,說明酒精度低于4%時,對紅曲霉的生長無影響;(2)傳統發酵第4~5天的酒精度(9%,12%)對應的紅曲霉菌量居中,且在后續發酵中持續上升至與KB相當,有研究表明紅曲霉可以耐受10%左右的乙醇,說明此時的酒精度已臨近紅曲霉的耐受范圍,紅曲霉的生長開始受到抑制;(3)傳統發酵第6~30天的酒精度,這些酒精度下對應的紅曲霉菌量最少,且在后續發酵中,第6~10天的酒精度下紅曲霉菌量迅速增加,而發酵第20~30天的酒精度下紅曲霉的菌量則增加緩慢,抑制作用更明顯,該結果與DGGE圖譜的菌量變化相一致,即紅曲霉的條帶在發酵第20天明顯變淡。
3結論
試驗結果表明傳統釀造體系的優勢真菌為釀酒酵母和紅曲霉,其中紅曲霉在發酵前3 d占優勢,之后其菌量逐漸下降,而釀酒酵母在發酵第3天后逐漸增加,并隨著發酵時間的延長逐步取代紅曲霉成為釀造中后期的優勢菌。在模擬傳統和純菌發酵過程中,模擬傳統體系可以重現紅曲霉的生長趨勢,而純菌發酵體系說明了封壇前期溶氧量的暫時減少并不能顯著抑制紅曲霉的生長。根據前期的對比研究,初步推測紅曲米的物理束縛、紅曲浸泡液中的物質以及酒精度的增加可能會抑制紅曲霉生長,針對這3個可能的影響因素構造3種體系,結果發現,前兩者對于紅曲霉的生長并不會起到顯著的抑制作用,而酒精度的增加是影響紅曲霉生長的關鍵因子。試驗進一步對傳統釀造過程中酒精度的變化與紅曲霉生長的關系進行深入研究,結果發現,發酵初期的酒精度(體積分數0~4%)對紅曲霉無影響,而隨著酒精度的增加,紅曲霉的生長逐漸受到抑制,至發酵后期的酒精度(體積分數17%)對紅曲霉的抑制作用顯著,因而導致紅曲霉在DGGE上的條帶在發酵第20天明顯變淡。
