腸道微生物競爭有限資源,加速抗生素的發(fā)現(xiàn)
人類的腸道內(nèi)平均含有大約100萬億個細菌,這些微生物為了生存而競爭有限的資源。賓夕法尼亞大學工程與應(yīng)用科學學院生物工程系助理教授César de la Fuente說:“這是一個非常激烈的環(huán)境。所有這些細菌共存的同時也在互相競爭。而這種環(huán)境恰恰能夠激發(fā)微生物產(chǎn)生新的機制。”
在這種沖突中,de la Fuente實驗室看到了新抗生素的潛力,如果腸道內(nèi)的細菌為了生存必須發(fā)展出新的策略,那么為什么不利用這些策略來對抗它們呢?
在一項新的研究中,de la Fuente實驗室和斯坦福大學的Ami S.Bhatt教授對近2000人的腸道微生物組(gut microbiome)進行了調(diào)查,發(fā)現(xiàn)了數(shù)十種潛在的新抗生素。相關(guān)研究結(jié)果于2024年8月19日在線發(fā)表在Cell期刊上,論文標題為“Mining human microbiomes reveals an untapped source of peptide antibiotics”。
de la Fuente認為生物學是一種信息源。“一切都是代碼,”他說,“如果我們能夠開發(fā)出一種算法來解讀這些代碼,就能極大地加速抗生素的發(fā)現(xiàn)。”近年來,de la Fuente實驗室因其在各種意想不到的地方發(fā)現(xiàn)候選抗生素而受到關(guān)注,包括已滅絕生物如尼安德特人和長毛象的遺傳信息,以及利用人工智能分析大量細菌遺傳物質(zhì)的工作。
他們的目標之一是分析全球生物信息,作為抗生素和其他有用分子的來源。他們不再依賴傳統(tǒng)的采集土壤或水樣并從中提取活性化合物的方法,而是利用基因組、宏基因組和蛋白質(zhì)組中的大數(shù)據(jù)。這使得他們能夠以更快的速度發(fā)現(xiàn)新的抗生素。
考慮到細菌的快速進化,de la Fuente和他的合著者假設(shè),一個充滿競爭的環(huán)境,例如人類的腸道,可能是無數(shù)未被發(fā)現(xiàn)的抗菌化合物的寶庫。“當資源稀缺時,生物學才會真正展現(xiàn)出其創(chuàng)新的一面,”de la Fuente說。
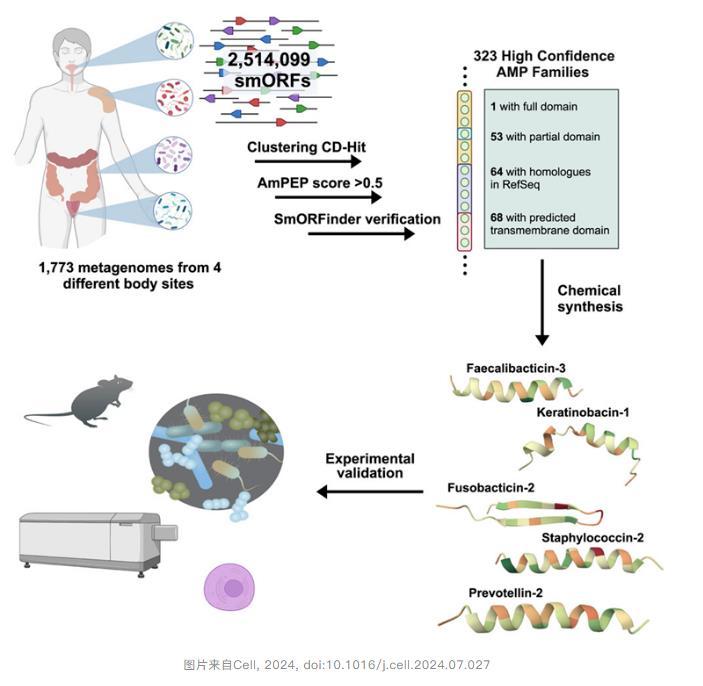
研究團隊專注于肽,即氨基酸短鏈,這類物質(zhì)之前被證明有潛力成為新的抗生素。他們通過計算分析了超過40萬種蛋白質(zhì),利用人工智能讀取遺傳密碼,并通過訓(xùn)練來預(yù)測哪些遺傳序列可能具有抗菌特性。
論文的第一作者,de la Fuente實驗室的助理研究員Marcelo D.T.Torres指出,“這些分子的構(gòu)成與傳統(tǒng)意義上的抗生素不同。我們發(fā)現(xiàn)的這些化合物構(gòu)成了一個新的類別,它們的獨特性質(zhì)將有助于我們理解和擴展抗菌劑的序列空間。”
當然,這些預(yù)測需要通過實驗來驗證。在篩選出數(shù)百種候選抗生素后,研究團隊選擇了78種進行實際細菌測試。在合成這些多肽之后,他們讓細菌培養(yǎng)物接觸到每種多肽,并觀察哪種肽能成功抑制細菌生長。此外,他們還在動物模型中測試了這些候選抗生素。
結(jié)果表明超過一半的肽有效,即它們抑制了有益或有害細菌的生長,而主要候選抗生素prevotellin-2的抗感染能力與FDA批準的抗生素多粘菌素B相當,顯示出人類腸道微生物組可能蘊藏著未來可用于臨床治療的抗生素。
Bhatt評論道,“prevotellin-2的活性與我們最后防線之一的多粘菌素B相當,這個發(fā)現(xiàn)讓我感到十分驚訝。這表明,從人類微生物組中挖掘新型抗菌肽,對于科學家、醫(yī)生以及患者來說,是一條極具前景的道路。”
相關(guān)新聞推薦
1、大腸埃希菌的菌落數(shù)范圍、貯藏條件、活性及性狀的穩(wěn)定性【實驗】
2、大腸桿菌噬菌體Bp4抗性菌株與其敏感菌株培養(yǎng)特性及耐藥性檢測(二)
