鵪鶉肺炎克雷伯菌血清型鑒定、耐藥性檢測及致病潛力(二)
1.516SrDNA鑒定和遺傳進(jìn)化分析
使用細(xì)菌基因組DNA提取試劑盒提取純培養(yǎng)菌株的全基因組,參考Colodner等方法使用16SrDNA通用引物27F(5‘-AGAGTTTGATC-MTGGCTCAG-3’)和1492R(5‘-GGTTACCTTG-TTACGACTT-3’)進(jìn)行PCR擴(kuò)增,PCR反應(yīng)體系25μL:2×EasyTaqPCRSuperMix(+Dye)12.5μL,上、下游引物各0.6μL,DNA模板1.0μL,ddH2O10.3μL.PCR擴(kuò)增程序:94℃預(yù)變性5min;94℃變性30s,54℃退火30s,72℃延伸30s,共35個循環(huán);72℃延伸10min;4℃保存。PCR產(chǎn)物用1.0%瓊脂糖凝膠電泳檢測,并送至生工生物工程(上海)股份有限公司進(jìn)行測序拼接,測序結(jié)果在NCBI中BLAST進(jìn)行序列比對,使用Mega11.0軟件構(gòu)建系統(tǒng)進(jìn)化樹。
1.6肺炎克雷伯菌特異性
基因檢測以提取的細(xì)菌DNA為模板,參考吳自豪等研究報道的引物(F1:5‘-CGATTCTGGAAATGG-CAAAAG-3’;R1:5‘-CGTGATCAGCGGTGACT-ATGAC-3’),對腸桿菌科特異性基因phoA進(jìn)行PCR擴(kuò)增,預(yù)期擴(kuò)增產(chǎn)物大小為720bp.PCR反應(yīng)體系及程序同1.5,其中退火溫度為58℃。參考王樂等方法,使用特異性引物(F2:5‘-TGA-TTGCATTCGCCACTGG-3’;R2:5‘-GGTCAACC-CAACGATCCTG-3’)對肺炎克雷伯菌溶血菌素基因khe進(jìn)行PCR擴(kuò)增,預(yù)期擴(kuò)增產(chǎn)物大小為498bp.PCR反應(yīng)體系及程序同1.5,其中退火溫度為56℃。PCR擴(kuò)增產(chǎn)物用1.0%瓊脂糖凝膠電泳檢測。
1.7肺炎克雷伯菌莢膜血清型檢測
參考解秀梅等研究合成肺炎克雷伯菌7種常見莢膜血清型引物,PCR反應(yīng)體系及程序同1.5,退火溫度見表1.PCR擴(kuò)增產(chǎn)物通過1.0%瓊脂糖凝膠電泳檢測。
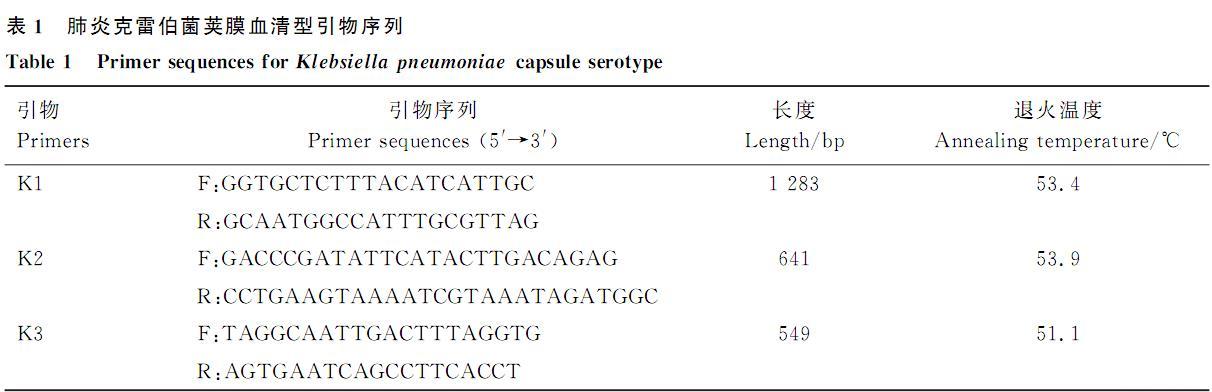

表1肺炎克雷伯菌莢膜血清型引物序列
1.8藥物敏感性檢測
使用K-B法檢測分離菌株對β-內(nèi)酰胺類、四環(huán)素類、氯霉素類、多肽類、氨基糖苷類、磺胺類、喹諾酮類以及大環(huán)內(nèi)酯類等9大類24種常見抗菌藥物的敏感性。用無菌涂布器將純培養(yǎng)菌液均勻涂布于LB瓊脂培養(yǎng)基,并在 oCelloScope 中于 37°C 下培養(yǎng)(無需搖動)。每 30分鐘至 10 小時采集一次圖像。每個樣品一式三份進(jìn)行分析,并計算平均值和標(biāo)準(zhǔn)差。
1.9耐藥基因檢測
參考文獻(xiàn)合成肺炎克雷伯菌5大類11種耐藥基因引物,PCR反應(yīng)體系及程序同1.5,退火溫度見表2.PCR擴(kuò)增產(chǎn)物進(jìn)行1.0%瓊脂糖凝膠電泳檢測。

表2耐藥基因引物序列
1.10毒力基因檢測參考文獻(xiàn)合成肺炎克雷伯菌18種毒力基因特異性引物,利用PCR擴(kuò)增檢測分離株攜帶毒力基因情況。PCR反應(yīng)體系及程序同1.5,退火溫度見表3,PCR產(chǎn)物進(jìn)行1.0%瓊脂糖凝膠電泳檢測。
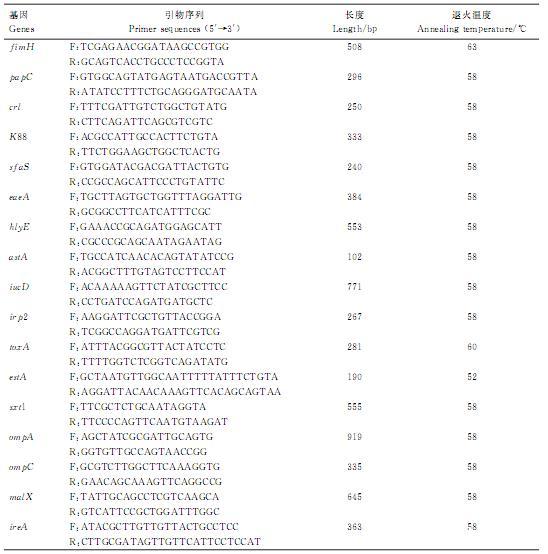
表3毒力基因引物序列
1.11生物學(xué)特性分析
1.11.1生長曲線測定
實驗中,將過夜培養(yǎng)的細(xì)菌稀釋至初始細(xì)胞密度為104CFU/mL,然后將不同濃度的XO和LPO添加到96孔板中,每種條件設(shè)置三份重復(fù)。oCelloScope被放置在37°C、5%CO?的培養(yǎng)箱中,每隔15分鐘對每個孔進(jìn)行兩次掃描,持續(xù)監(jiān)測24小時。通過背景校正的吸收算法,生成細(xì)菌生長曲線,并計算每個時間點的平均增長量。以接種時間為橫軸、D600nm值為縱軸繪制細(xì)菌生長曲線。
1.11.2酸堿耐受性測定
取150μL純培養(yǎng)菌液分別接種于5mLpH為2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的LB肉湯培養(yǎng)基,于37℃、180r/min搖床孵育24h,使用丹麥Biosense微生物動態(tài)曲線監(jiān)測系統(tǒng)測定菌液D600nm值,試驗設(shè)置3個重復(fù),取平均值,利用Origin2024軟件作圖,以pH為橫軸、D600nm值為縱軸繪制pH穩(wěn)定曲線。
1.11.3接種量測定
分別向5mLLB肉湯培養(yǎng)基中加入50、100、150、200、250μL純培養(yǎng)菌液,使接種量依次達(dá)到培養(yǎng)基體積的1%、2%、3%、4%、5%,于37℃、180r/min搖床孵育12h,使用丹麥Biosense微生物動態(tài)曲線監(jiān)測系統(tǒng)測定菌液D600nm值,試驗設(shè)置3個重復(fù),取平均值,利用Origin2024軟件作圖,以接種量為橫軸、D600nm值為縱軸繪制接種曲線。
1.12致病性試驗
將分離菌接種于LB液體培養(yǎng)基中,并于最適條件下培養(yǎng),隨后進(jìn)行平板計數(shù),并計算其菌液濃度,按照測定結(jié)果,將菌液稀釋成不同濃度(1×105、1×106、1×107、1×108、1×109CFU/mL)。將120只小鼠分為12組,其中2組為對照組,其余10組為不同濃度菌株處理組(每株菌5個濃度組),每組10只小鼠。對照組小鼠注射0.5mL生理鹽水,其他各組小鼠分別注射不同濃度菌液(0.5mL/只)。攻毒12h后開始觀察,記錄1周內(nèi)小鼠發(fā)病和死亡情況,用寇氏改良法計算分離菌株對小鼠的半數(shù)致死量(LD50)。
相關(guān)新聞推薦
1、甘肅隴南油橄欖葉提取物對幾種常見細(xì)菌生長曲線的影響
3、無性型蟲草菌株qsun-1發(fā)酵培養(yǎng)基組成成分優(yōu)化及生長影響因素
4、?微生物生長動態(tài)監(jiān)測系統(tǒng)揭示:膳食干預(yù)比微生物移植更有效驅(qū)動小鼠菌群重建
