雞印第安納株沙門菌生長、致病性及藥物敏感性研究(二)
1.4生長曲線測定
將分離的菌株接種到LB培養(yǎng)基中,于37℃搖床振蕩培養(yǎng),采用全自動微生物生長動態(tài)監(jiān)測系統(tǒng)測定菌液600 nm的吸光值(OD600),當OD600值達到1時,將菌液按1∶100進行稀釋后,接種到新鮮的LB培養(yǎng)基中120 r/min搖床培養(yǎng),每隔1 h取出,測定OD600值,連續(xù)測16 h,繪制菌液吸光度曲線;分別在1、2、4、8、10、12、14、16 h吸取培養(yǎng)菌液,用LB肉湯進行10倍梯度稀釋,并接種在LB平板上,37℃培養(yǎng)16 h,計數菌落,繪制活菌數變化曲線。
1.5毒力測定
將分離鑒定后的菌株接入LB液體培養(yǎng)基,37℃200 r/min培養(yǎng)12 h獲得菌液。將菌液離心,收集菌體,使用生理鹽水清洗菌體2次后備用。將30只3日齡SPF雛雞隨機分為5組,每組6只。第1~5組雛雞肌肉注射菌液,接種劑量依次為1.50×107、1.50×106、1.50×105、1.50×104、1.50×103 CFU,對照組雛雞接種等量生理鹽水,觀察7 d內雛雞發(fā)病及死亡情況,并計算分離菌半數致死量(LD50)。在接種后第3天,對3只病死雛雞和2只健康雛雞進行解剖檢查,觀察組織器官病變情況。
1.6耐藥性檢測
取分離菌株接種于LB培養(yǎng)基,于37℃搖床振蕩培養(yǎng)過夜。用無菌生理鹽水將菌液稀釋至0.5麥氏濁度標準。取滅菌棉簽蘸取菌液均勻地涂布于MH瓊脂平板。按WHO提供的Kindy-Bauer操作方法將藥敏紙片貼在涂布細菌的MH瓊脂平板上,37℃過夜培養(yǎng),測量抑菌圈的直徑,按照藥敏紙片說明書進行藥物敏感性判定。
1.7全基因組測序分析
分離菌株的全基因組測序委托上海凌恩生物科技有限公司完成,測序過程按照標準流程進行。提取高質量細菌DNA并進行質量檢測,采用PacBio平臺構建測序文庫、文庫質量檢測和文庫測序,使用Unicycler v0.4.8以默認參數進行基因組組裝,并通過Circlator v1.5.5軟件構建菌株完成圖。細菌基因模型使用GeneMarkv4.17進行識別。將所有基因模型與NR、eggNOG、SwissProt、KEGG、COG數據庫模塊進行比對,完成基因功能注釋。利用綜合的抗生素抗性基因數據庫CARD發(fā)掘分離株的耐藥基因。采用毒力因子數據庫VFDB比對菌株的毒力因子。使用SeqSero 1.2數據庫對菌株進行血清型分析,PlasmidFinder 2.1分析質粒類型;采用IECfinder預測基因組的可移動元件。
1.8比較基因組學分析
以NCBI數據庫中6株國內分離的雞源印第安納沙門菌基因組作為參考基因組,與測序獲得的分離株SM24全基因序列進行比較分析,6株參考菌株的信息見表1。
采用序列比對軟件MUMmer鑒定菌株的同源基因,并使用CD-HIT快速聚類分析對菌株基因組Core/Pan基因進行聚類,鑒定菌株共有和特有基因。利用MUSCLE軟件進行菌株Core基因多序列比對,并使用PhyML軟件中的最大似然法(ML法)構建菌株進化樹。
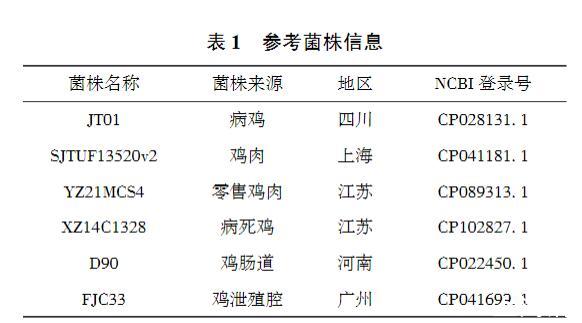
表1參考菌株信息
2結果與分析
2.1沙門菌分離與鑒定
發(fā)病雞病料經PBW預增菌和MM培養(yǎng)基的選擇性增菌,接種至XLT4選擇性平板上,37℃培養(yǎng)24 h,其中1份樣品培養(yǎng)出圓形、邊緣整齊、呈灰白色,中心呈黑色、大小均一的單一菌落(圖1A)。經革蘭染色,該菌被染成紅色,菌體呈短桿狀(圖1B),初步判定該菌為革蘭陰性的沙門菌。提取細菌基因組,采用細菌通用16S rRNA引物進行擴增,獲得大小為1 500 bp左右的PCR產物(圖2),并對產物進行測序,將16S rRNA基因序列在NCBI數據庫進行BLAST比對,其序列與沙門菌屬的同源性均高·26·Animal Husbandry&Veterinary Medicine 2025 Vol.57 No.4于99%,因而確定分離菌株為沙門菌,命名為SM24株。
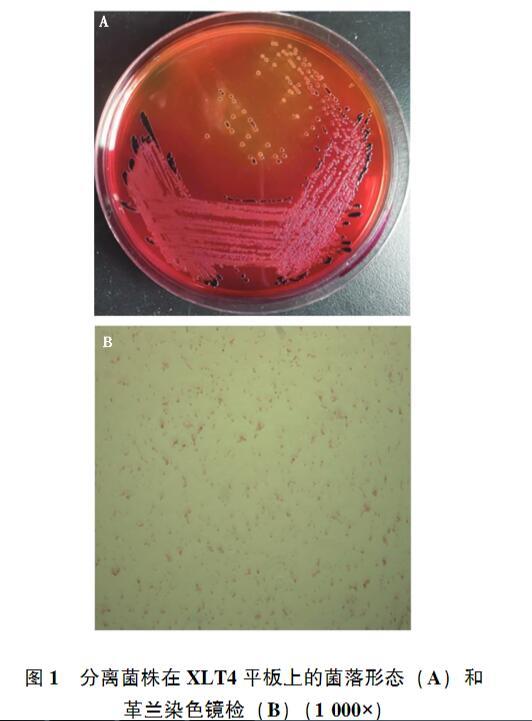
圖1分離菌株在XLT4平板上的菌落形態(tài)(A)和革蘭染色鏡檢(B)(1 000×)M.DL2000 DNA Marker;1、2.16S rRNA基因的PCR產物。
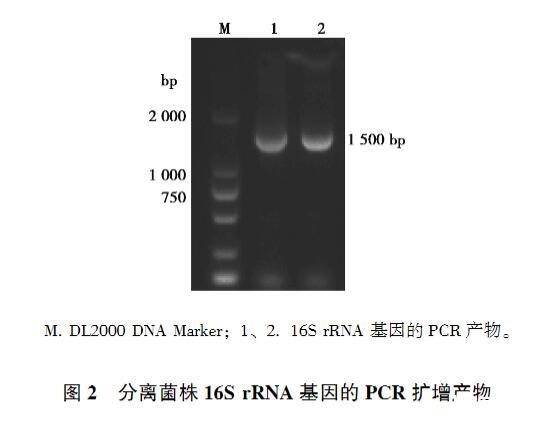
圖2分離菌株16S rRNA基因的PCR擴增產物
相關新聞推薦
1、?土壤中有哪些微生物?土壤微生物在生態(tài)系統(tǒng)中的作用
2、恒河猴肺中陰溝腸桿菌的分離鑒定及藥物敏感性試驗——結果、討論
3、不同種類、濃度可同化氮藍莓果酒中酵母菌計數、生長速率(一)
