高效乳酸菌和纖維素分解菌混合培養是否會相互抑制生長?
目前,國內外在飼料乳酸菌提高飼料發酵品質等方面進行了大量研究并取得了一定的效果。但是,由于秸稈細胞壁的纖維素成分含量較高,限制了該類飼料消化率的提高。為了解決該問題,國內外主要研究方法就是將纖維素酶制劑添加到青貯飼料中。但纖維素酶制備復雜,投資成本也相對較高。因此,纖維素分解菌作為添加劑是降低投資成本的有效方法。但是,對于乳酸菌與纖維素分解菌作為混合添加劑應用于改善青貯飼料發酵品質的研究在國內目前是個新領域,在國外的研究也很少。
測定高效乳酸菌和纖維素分解菌混合培養有無相互抑制作用是本研究的主要目的。在本研究中主要應用嚴萍(2011)從青貯玉米中分離得到的高效乳酸菌與本科研組人員從瘤胃中分離得到的纖維素分解菌混合培養,以判定兩者是否會相互抑制生長,從而對研發混合添加劑提供參考。
1材料與方法
1.1試驗材料
采用本研究室分離得到的4株菌株,分別是高效乳酸菌A4、A7和纖維分解菌Nf、Y6。
MRS培養基:用于乳酸菌A4、A7的活化培養。
羧甲基纖維素鈉培養基:用于纖維素分解菌Nf、Y6的活化培養。
2%糖水:為了讓試驗結果更接近實地青貯試驗,采用2%糖水培養混合菌株。
儀器設備:分光光度計、滅菌鍋、恒溫培養箱。
1.2試驗設計
1.2.1試驗流程
已分離得到的凍存菌株→初次活化→二次活化→測活菌數→按比例混合加入到2%糖水中→每4 h測OD值→達到穩定期測活菌數→畫出生長曲線→結果分析。
1.2.2試驗所用菌株準備
將分離后凍存的乳酸菌和纖維素分解菌各取出0.4 ml分別加入到10 ml MRS液體培養基和羧甲基纖維素鈉液體培養基中,在35℃培養,纖維素分解菌培養28 h再次活化。乳酸菌培養18~20 h再次活化,并且第二次活化時間為16 h。
1.2.3活菌數測定
在混合培養之前和混合培養達到穩定期時都要進行活菌數測定。穩定期測活菌數是將混合培養液分別用MRS和羧甲基纖維素鈉固體培養基培養,由于纖維素分解菌可在MRS培養基上生長,而乳酸菌不能在羧甲基纖維素鈉培養基上生長(已在試驗中得到),由此可分別測出兩者活菌數。
活菌數測定:吸取0.5 ml待測菌液用滅菌的生理鹽水進行10倍梯度稀釋,選擇適當的稀釋梯度,吸取200μl菌懸液置于平板內,加入15 ml左右的MRS培養基混勻,每個稀釋梯度3個平行。平板在37℃恒溫培養箱培養48 h后,選擇菌落數在30~300之間的平板進行計數。
1.2.4混合培養及生長曲線的測定
將兩種菌培養液按表1中比例進行混合加入到2%蔗糖溶液中,35℃培養48 h,以空白2%蔗糖溶液為對照,每4 h測定樣品的吸光值OD600,以時間為橫坐標,吸光度值為縱坐標,繪制混合菌的生長曲線。
2試驗結果
2.1生長曲線的測定
試驗所得的混合菌OD值生長曲線見圖1、圖2。
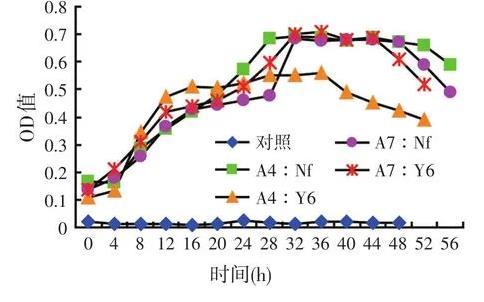
圖1混合菌生長曲線
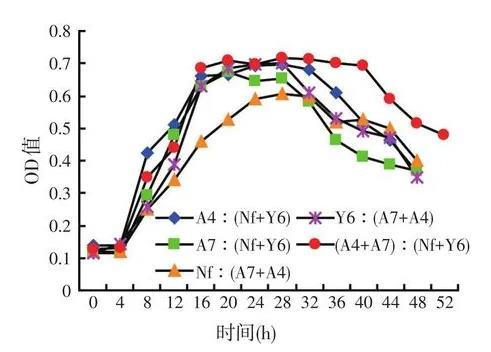
圖2混合菌生長曲線
在圖1中可看出,除了對照組所有試驗組都在4 h進入生長期,單獨混合乳酸菌和纖維素分解菌,其達到穩定期的時間較長,在4個試驗組中第一組A4∶Nf 28 h率先達到穩定期,且生長情況較好。
由圖2可知,5組試驗組達到穩定期的時間都比單獨混合菌短,都在16~20 h之間,其中[(A4+A7)∶(Nf+Y6)]的穩定期時間為16 h。
2.2活菌數測定
混合培養前不同菌株培養液中活菌數見表2。

表2原培養液中的活菌數
混合培養后活菌數見圖3。在圖3中可看出,乳酸菌活菌數在A4∶Nf、A7∶Y6、A4∶Y6、(A4+A7)∶(Nf+Y6)試驗組中都較高,而纖維素分解菌在A4∶Nf、A7∶Y6、(A4+A7)∶(Nf+Y6)試驗組中較高。兩者均高的有A4∶Nf和(A4+A7)∶(Nf+Y6)試驗組,其中(A4+A7)∶(Nf+Y6)試驗組的最好。
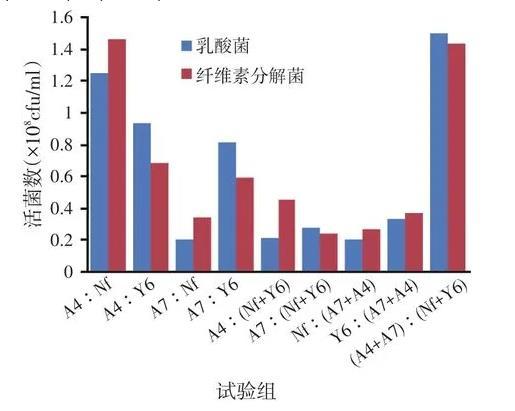
圖3各個試驗組活菌總數
3結論與討論
①根據阿布都克尤木·麥麥提(2012)、買爾哈巴·艾合買提等(2013)研究結果可知,本試驗所用乳酸菌達到穩定期約在16 h左右,纖維素分解菌則在28 h左右才會達到穩定期。而在本試驗研究中試驗組(A4+A7)∶(Nf+Y6)穩定期時間段為16 h,說明4種菌株全混合添加時可促進彼此生長。
②由試驗所得到的生長曲線和活菌數可看出,各個試驗組達到穩定期時活菌數都有增長,而且其中(A4+A7)∶(Nf+Y6)組的生長情況最好,可初步確定本研究所用到的乳酸菌和纖維素分解菌并不相互抑制彼此生長。
③最近研究的青貯飼料生物添加劑主要包括乳酸菌接種劑和纖維素酶制劑。本研究初步得出,乳酸菌和纖維素分解菌并不互相抑制,為研發出纖維素分解菌代替纖維素酶與乳酸菌混合作為添加劑提供了一定的試驗依據,并且進一步制定出高品質飼料制作模式提供了基礎。
相關新聞推薦
1、基于ELISA和細菌生長曲線應用的結合定量檢測腸炎沙門氏菌(二)
