微生物合成食品功能因子方法、研究策略和進展(二)
2重編程細胞能量代謝
能量代謝在細胞生長和中心代謝途徑中發揮重要作用,操縱能量代謝是優化微生物生長適應性和實現產物高產量、高產率和高生產強度相統一的有效策略[65,66].ATP作為最重要的能量來源,調控ATP供應是調節細胞工廠代謝流分布、生物量積累和產物合成的重要手段[67,68].有氧條件下細胞主要通過氧化磷酸化途徑合成ATP,因此操縱該途徑可以有效調節細胞內ATP的濃度,其中主要通過調控NADH水平、ATP合酶活性和電子傳遞鏈來調節ATP代謝.
2.1調控NADH供給
細胞內NADH主要來源于糖酵解、脂肪酸氧化和三羧酸循環,所以可以根據NADH代謝來調控NADH相關酶的活性進而調節胞內ATP水平.Zhu和Shimi zu[69]敲除E.coli中編碼丙酮酸甲酸裂解酶的pfl基因,從而導致胞內NADH/NAD+比率顯著升高,ATP/AMP水平降低,同時在以葡萄糖為碳源時菌株的糖酵解通量顯著增加.研究人員通過調控E.coli TCA循環中相關基因的表達,增強了TCA循環的碳通量和胞內ATP水平,導致β-胡蘿卜素[70]和番茄紅素[71]產量顯著增加.為實現異丁醇的快速高效生產,研究人員對合成異丁醇的B.subtilis進行代謝網絡分析,揭示了NADPH對異丁醇生物合成的重要性[72].因此在氧化還原失衡且NADPH過量的情況下,強化表達來源于E.coli的udhA基因提高胞內NADH和ATP濃度,最終細胞生長性能得到優化,異丁醇產量提高.敲除S.cerevisiae中消耗NADH的乙醇脫氫酶的同時過表達生成NADH的乙醛脫氫酶,可提高胞內NADH的水平和甘油的產量[73].此外,在培養基中補充依賴NAD+脫氫酶的相關底物[74],可以有效調控胞內ATP濃度,從而提高產物合成效率.通過調控NADH供給實現上調或下調胞內ATP水平的策略較為清晰簡便,且調控效果顯著,但NADH濃度的變化可能會破壞胞內氧化還原的平衡,因此需要考慮細胞的氧化還原狀態是否利于產物合成.
2.2調控F0F 1-ATP合酶表達
在氧化磷酸化過程中,電子傳遞鏈產生的質子動力通過ATP合酶驅動ATP生成,因此操縱F0F 1-ATP合酶表達是調控ATP水平最直接有效的方法.在E.coli中強化ATP合酶基因操縱子的表達提升胞內ATP水平,可有效提高β-胡蘿卜素的產量[70].Zhang等人[75]在S.cer evisiae中表達來源于擬南芥(Arabidopsis thaliana)的ATP6基因,提高了ATP水平;后將該基因在產朊假絲酵母(Candida utilis)中進行表達,提高了胞內F0F 1-ATP合酶的活性和胞內ATP水平,同時菌株的生物量提高且S-腺苷甲硫氨酸和谷胱甘肽的合成增強[76].
由于ATP合酶的F1亞基具有水解ATP的功能,因此表達該亞基會促進ATP水解從而降低ATP的濃度.在E.coli中表達ATP合酶的F1亞基降低了胞內ATP水平,并顯著提高菌株對葡萄糖的攝取速率和乳酸合成能力[77].利用類似的策略,在糖多孢紅霉菌(Saccharopo lyspora erythraea)表達F1亞基導致較低的[ATP]/[ADP]比,維持了細胞的氧化還原平衡狀態,紅霉素合成能力提高28%[78],同樣該策略提高了乳酸乳球菌(Lactococ cus lactis)的乙偶姻合成能力[79].因此對于可產生質子動力的菌株,操縱ATP合酶活性可有效調控胞內ATP的供應,并改善生產菌株生物量的累積和與ATP合成相關的目標代謝物的生產.
2.3調控電子傳遞鏈
在氧化還原反應中,電子傳遞鏈上電子轉移過程中產生的質子梯度可用于胞內ATP合成.在有氧發酵中,氧氣是電子傳遞鏈的最終電子受體,因此氧氣濃度是影響胞內ATP含量的關鍵因素[80].尤其是某些高密度、高能量的發酵體系中氧氣的豐度是ATP合成的重要條件[81].調控發酵罐的攪拌速度或在發酵過程通入氧氣是較為簡單的氧氣供給策略[82].另一種策略是添加一定濃度的正己烷、正庚烷、血紅蛋白和正十六烷等攜氧載體,該策略也可提高氧濃度[83~86].E.coli發酵過程中血紅蛋白的添加使細胞生物量提高約11%[85].Li等人[86]在培養基中加入正十六烷,促進S.cerevisiae胞內ATP積累,S-腺苷甲硫氨酸的產量達到2.27 g/L.此外,調控pH維持在酸性條件下可以提高胞內ATP水平.因為較低pH產生的質子梯度可驅動呼吸鏈中的F0F 1-ATP合酶活性[87,88].雖然通過調控電子傳遞鏈可以調節ATP代謝,但由于其涉及多個基因的調控,難以通過簡單的單基因或幾個相關基因的調控來調節胞內ATP水平.
ATP作為一類重要的輔因子,對代謝反應的速率、細胞的生長和產物合成具有重要的調控意義.胞內ATP水平對不同產物的影響不同,胞內高濃度的ATP可以促進多糖等食品功能因子的合成[89],而谷氨酸等代謝物的合成則需要維持低濃度ATP,因此需要平衡宿主胞內ATP水平和細胞生長之間的關系,從而實現產品的高效合成.
3細胞生長與產物合成偶聯
采用傳統微生物代謝工程策略對細胞工廠進行改造可能會導致代謝通量失衡或代謝負擔,從而使得細胞生長性能受損和生產性能減弱,特別是具有高度工程化或遺傳回路的微生物往往會在長期發酵中失去生產表型[90,91].為了解決該問題,一種策略是將細胞生長與產物合成相偶聯,使生產適應細胞的生長,實現生長和產物合成之間的平衡[92,93].
3.1營養缺陷系統與產物合成偶聯
營養缺陷與產物合成進行偶聯是一種生長與生產偶聯的方法,其中產物合成對于細胞生長是必需的.Atsumi和Liao[94]在異亮氨酸營養缺陷型E.coli中引入檸蘋酸途徑合成α-酮戊二酸,從而為1-丙醇和1-丁醇的合成提供前體,且α-酮戊二酸可進一步轉化為異亮氨酸,使得該菌株能夠恢復生長能力,但生長速率仍低于直接添加異亮氨酸的情況.后對該途徑的關鍵酶CimA進行定向進化,篩選得到生長速率高于野生型的突變株,并顯著提高1-丙醇和1-丁醇產量.Ye等人[95]發現,合成番茄紅素的S.cerevisiae在繼代培養時出現白色菌落,猜測可能是由于GAL調控系統的破壞導致途徑基因轉錄被抑制從而不能合成番茄紅素,所以出現菌株表型退化的現象.菌株是需要表達URA3才能正常生長的尿嘧啶缺陷型菌株,編碼番茄紅素合成的基因由GAL啟動子驅動表達.為了實現生長與合成偶聯,研究人員利用GAL啟動子同時控制URA3和番茄紅素途徑基因的表達,從而導致在長期培養中GAL系統破壞的菌株無法正常生長.當葡萄糖存在時,葡萄糖誘導的啟動子PH XT1開啟URA3的表達,細胞正常生長.當葡萄糖耗盡時,PG AL啟動子激活產物合成相關基因和偶聯的URA3基因表達,從而賦予生產細胞生長優勢.將該策略用于S.cerevisiae高效合成(+)-瓦倫亞烯,產量達到16.6 g/L.
此外,研究人員拓展了模塊化細胞(modular cell,MODCELL)[96]的設計原理以優化生長偶聯效果.模塊化細胞是一種營養缺陷型細胞,包含必要但不足以支持細胞生長和維持代謝的中心代謝途徑,因此必須與可變的產物合成模塊偶聯.該模塊可以輔助細胞生長,維持細胞代謝并增強產物的合成,通過優化兩者之間的偶聯強度可以快速篩選最優生產宿主,并通過乙醇的生物合成進行了驗證[97].
3.2基于群體質量控制和代謝產物成癮系統的生長與產物合成偶聯
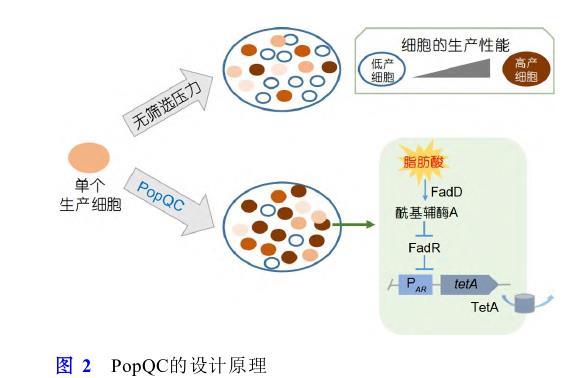
代謝負擔常常導致生產細胞表現出降低的生長適應性,由于遺傳和不可遺傳變異導致的非生產細胞亞群由于缺乏代謝負擔而恢復生長適應性,并可以快速占據細胞群體,從而降低生產能力[98,99].對抗代謝異質性的一個策略是將代謝產物的合成與細胞生長進行偶聯,從而解決非生產亞群導致的細胞群體生產能力流失的問題.對此,Xiao等人[100]提出了群體質量控制系統(population quality control,PopQC)的概念.首先在E.coli中開發一種基于調控因子FadR且響應目標產物的生物傳感器,該傳感器響應游離脂肪酸的濃度,在低產細胞或者非生產細胞中轉錄調控因子FadR與PA R啟動子結合,抑制編碼四環素外排蛋白基因tetA的表達;而在高產細胞內,隨著游離脂肪酸濃度的增加,其會解除FadR對相應啟動子的阻遏作用,tetA基因正常表達.因此,在四環素存在的情況下,PopQC富集高產細胞并使之占據主導地位,最終游離脂肪酸的產量提高3倍(圖2),相同的策略使得酪氨酸產量提高2.6倍.同樣,Rugbjerg等人[101]利用胞內必需過程,
E.coli中設計了正向響應產物MVA的遺傳回路以調控必需基因的表達.當MVA產量較高時,生物傳感器與MVA結合從而激活必需基因的轉錄表達,導致菌株具有較高的生長速率;而當不存在MVA時,必需基因的表達也會被限制,從而導致較低的生長速率.因此在整個細胞群體中,生長緩慢的非生產細胞比例逐漸減少,具有高生長速率生產細胞逐漸占主導.最終,未改造的菌株在經過50次傳代后MVA合成能力逐漸喪失,而引入產物成癮系統的菌株在傳代95次后仍然擁有高產能力,并且該系統無需使用抗生素并且不存在宿主受限的問題.研究人員還將產物柚皮素成癮與負向自調控系統相結合,使得成癮酵母細胞培養324代后仍擁有90.9%的柚皮素生產能力,而正常細胞在傳代300代后丟失94.5%的生產能力,且恢復了正常生長[102].該策略同樣適用于以E.coli為底盤細胞合成柚皮素的研究[103].
代謝異質性已成為影響細胞生產性能的主要問題,通過激勵生產細胞和懲罰非生產細胞的方式可以用于對抗這種限制,從而通過富集生產細胞亞群穩定維持生產表型。
食品功能因子的可持續生物合成面臨的一個主要挑戰是擴大生產規模并維持高產性能.但是,異源基因表達引起的代謝負擔會產生選擇性壓力,從而導致培養體系中非生產種群的自發形成,使得高生產能力但適應性較低的細胞喪失優勢,最終導致整體生產性能下降.因此,將細胞生長與產物合成偶聯可以很好地解決這類矛盾,從而提升細胞群體的生產性能.
