微生物合成食品功能因子方法、研究策略和進展(三)
4細胞生長與產(chǎn)物合成解偶聯(lián)
產(chǎn)物的高效合成往往與底盤細胞生長競爭資源,在底物充足的條件下,對菌株生產(chǎn)力的最大限制來自用于支持細胞生長和內(nèi)源性基礎(chǔ)代謝所需資源的持續(xù)消耗.當導(dǎo)向目標代謝途徑的資源不足時,大量的底物主要用于細胞的生長,從而導(dǎo)致生產(chǎn)能力下降.相反,過度的分流會影響細胞的生長從而降低生產(chǎn)強度.微生物底盤細胞的這種局限性可通過將細胞生長與產(chǎn)物合成解偶聯(lián)來解決[104~106].將發(fā)酵過程解耦成生長和生產(chǎn)兩個階段進行動態(tài)調(diào)控,通過嚴格控制細胞的基礎(chǔ)生長,在發(fā)酵早期最大程度地積累生物量,然后通過誘導(dǎo)激活合成途徑將資源轉(zhuǎn)向生產(chǎn)途徑,這樣細胞可在半衰老狀態(tài)下工作,吸收利用底物進行產(chǎn)品合成。
4.1化合物誘導(dǎo)調(diào)控系統(tǒng)
特定化學(xué)物質(zhì)和營養(yǎng)成分可以作為用于解偶細胞生長的誘導(dǎo)劑[107,108].IPTG和無水四環(huán)素是常用的誘導(dǎo)劑,已被用于1,4-丁二醇[109]、異丙醇[110]和蘋果酸[111]等的生物合成調(diào)控.營養(yǎng)成分如甲硫氨酸被用于抑制PM ET3啟動子驅(qū)動的基因表達以解偶細胞生長,提高青蒿素前體紫穗槐二烯的生物合成[112].Tan等人[113]在S.cerevisiae中利用四環(huán)素轉(zhuǎn)錄激活系統(tǒng)將碳通量轉(zhuǎn)向產(chǎn)物合成,使得葡萄糖酸和異丁醇產(chǎn)量分別提高10倍和3倍.外源性誘導(dǎo)劑的動態(tài)調(diào)節(jié)是有效的,但需要精確控制誘導(dǎo)時間和誘導(dǎo)強度。
4.2群體感應(yīng)系統(tǒng)
基于內(nèi)源性壓力感應(yīng)機制,開發(fā)可自發(fā)調(diào)節(jié)的遺傳回路以控制代謝是解偶細胞生長的另一種策略.群體感應(yīng)(quorum sensing,QS)系統(tǒng)是一種響應(yīng)細胞密度的基因回路,可以根據(jù)細胞密度自適應(yīng)地將碳通量從生長轉(zhuǎn)移到生產(chǎn)途徑[114,115].目前研究最為廣泛的群體感應(yīng)系統(tǒng)主要是來自費氏弧菌的luxI/luxR系統(tǒng)[116]和來自玉米細菌性枯萎病菌的esaI/esaR系統(tǒng)[117].研究人員在E.coli中構(gòu)建基于luxI/luxR的群體感應(yīng)系統(tǒng)用于紅沒藥烯的生物合成,其生產(chǎn)能力比需要添加誘導(dǎo)劑的工程菌株提高44%[118].天然QS回路雖然可以響應(yīng)不同細胞密度進行動態(tài)調(diào)控,但是其動態(tài)調(diào)控的范圍較為狹隘.因此,Ge等人[119]通過優(yōu)化luxR-luxI基因間序列創(chuàng)建了一個具有高動態(tài)調(diào)控范圍和低泄漏率的QS突變體庫,將其應(yīng)用于以E.coli作為底盤細胞合成4-羥基香豆素,其產(chǎn)量提高11.3倍.此外,該QS系統(tǒng)也廣泛用于改善E.coli合成柚皮素[120]和中鏈脂肪酸[121]等.Corrêa等人[122]在B.subtilis中構(gòu)建了基于luxI/luxR的群體感應(yīng)系統(tǒng)自誘導(dǎo)基因回路(圖3),并用于核黃素的生產(chǎn).該系統(tǒng)包括兩大模塊,一個模塊是包含2種變體的誘導(dǎo)模塊——luxR和luxI基因以及各自的啟動子,另一個模塊是包含7種變體的應(yīng)答模塊——產(chǎn)物合成相關(guān)基因和控制基因表達的群體感應(yīng)啟動子.由LuxI合成的信號分子AHL擴散進入細胞,當AHL濃度達到一定閾值后與LuxR結(jié)合,從而激活應(yīng)答模塊中靶基因的表達.最終,最強響應(yīng)元件S1-R6的轉(zhuǎn)錄水平是B.subtilis內(nèi)源啟動子Pv eg的3.2倍,篩選得到的工程菌株顯示出響應(yīng)細胞密度的核黃素生產(chǎn)曲線.然而,該群體感應(yīng)系統(tǒng)只能正向響應(yīng)信號分子的濃度,需要利用負調(diào)控元件才可進行雙向調(diào)節(jié),這會導(dǎo)致菌株代謝負擔加重和靈敏性降低等問題。

與luxI/luxR不同的是,esaI/esaR系統(tǒng)中的信號分子受體EsaR具有同時產(chǎn)生激活和抑制的雙重作用.在低細胞密度和信號分子AHL不存在時,EsaR可與啟動子Pe saR的轉(zhuǎn)錄調(diào)控區(qū)結(jié)合抑制下游基因表達,也可與啟動子Pe saS的轉(zhuǎn)錄調(diào)控區(qū)結(jié)合激活下游基因表達;而在高細胞密度和AHL濃度積累到一定閾值后,AHL與EsaR作用使其無法再結(jié)合到轉(zhuǎn)錄調(diào)控區(qū),因此開啟Pe saR啟動子下游基因的表達和抑制Pe saS啟動子下游基因的表達[117].Gupta等人[123]通過微調(diào)EsaI的表達,利用該系統(tǒng)控制1-磷酸果糖激酶和莽草酸激酶的表達,成功實現(xiàn)了細胞生長與產(chǎn)物合成途徑碳通量的平衡,并有效提高E.coli中肌醇、葡萄糖二酸和莽草酸的產(chǎn)量。
由于真核生物的轉(zhuǎn)錄抑制需要染色質(zhì)重塑,所以將這兩類群體感應(yīng)系統(tǒng)應(yīng)用于S.cerevisiae仍具有挑戰(zhàn)性.因此,已經(jīng)設(shè)計了信息素群體感應(yīng)系統(tǒng)用于改善羥基苯甲酸(para-hydroxybenzoic acid,PHBA)[124,125]、2′-巖藻糖基乳糖和3′-巖藻糖基乳糖[126]的合成.此外,研究人員還在B.subtilis中構(gòu)建了基于Phr60-Rap60-Spo0A的雙功能群體感應(yīng)系統(tǒng)基因回路,通過解耦生長和合成將維生素K2產(chǎn)量提高40倍[127].群體感應(yīng)系統(tǒng)的深入研究為動態(tài)調(diào)控代謝途徑提供了新的指導(dǎo),但仍有不足之處.基于群體感應(yīng)的動態(tài)調(diào)控存在泄露表達,無法實現(xiàn)對目標基因的嚴謹調(diào)控,仍需對基因元件進行優(yōu)化或挖掘更多的動態(tài)調(diào)控元件等.其次,由于群體感應(yīng)系統(tǒng)的復(fù)雜性,其調(diào)控機制尚未完成解析明了,實現(xiàn)完全的宿主解偶聯(lián)也仍需進一步研究。
近年來,利用基于代謝物響應(yīng)轉(zhuǎn)錄因子的生物傳感器來重編程細胞活性也已取得重大研究進展[128].通過將傳感器——制動器與底盤細胞集成,以動態(tài)調(diào)控關(guān)鍵酶的表達并驅(qū)動碳通量轉(zhuǎn)向目標途徑.其中,丙二酰輔酶A是脂肪酸生物合成的前體,開發(fā)響應(yīng)丙二酰輔酶A的生物傳感器在克服限速途徑和優(yōu)化產(chǎn)量方面具有巨大的希望.FapR可以特異性響應(yīng)丙二酰輔酶A的濃度并調(diào)節(jié)B.subtilis脂肪酸生物合成途徑中相關(guān)基因的表達[129].Xu等人[130]設(shè)計響應(yīng)丙二酰輔酶A的雙啟動子傳感器動態(tài)調(diào)控胞內(nèi)丙二酰輔酶A的通量以優(yōu)化E.coli中脂肪酸的生物合成.在E.coli中,丙二酰輔酶A是通過accABCD基因編碼的乙酰輔酶A羧化酶催化乙酰輔酶A合成,而低水平的丙二酰輔酶A使FapR處于活性狀態(tài),由p GAP啟動子驅(qū)動的accABCD基因被激活,同時由T7啟動子驅(qū)動的脂肪酸合成途徑被抑制,從而使丙二酰輔酶A得以在胞內(nèi)積累.隨著細胞生長,丙二酰輔酶A積累到一定濃度時,開-關(guān)狀態(tài)被轉(zhuǎn)換從而開啟脂肪酸的生物合成,使得細胞生長與產(chǎn)物合成解偶聯(lián).后通過優(yōu)化FapR阻遏物結(jié)合位點fapO的數(shù)量,使得脂肪酸產(chǎn)量提高至3.86 g/L.另外也有研究通過設(shè)計分層遺傳回路[106]和代謝轉(zhuǎn)換開關(guān)[110]實現(xiàn)細胞生長與生產(chǎn)解偶聯(lián),從而提高目標產(chǎn)物的合成.細胞生長與產(chǎn)物合成解偶聯(lián)可以通過嚴格控制非必需基因的基礎(chǔ)表達,使得代謝負擔最小化,從而在發(fā)酵早期階段最大限度積累生物量.一旦達到一定的細胞密度時,便可將資源轉(zhuǎn)移至產(chǎn)物合成途徑從而實現(xiàn)高產(chǎn).同時,生長與生產(chǎn)解偶聯(lián)可以很好地避免有毒中間體的積累或?qū)毎卸拘缘拿傅倪^量表達,抑制合成毒性中間體的上游途徑并在適當時間激活利用它的下游產(chǎn)物合成途徑,從而更好地平衡細胞生長和產(chǎn)物合成。
5結(jié)論與展望
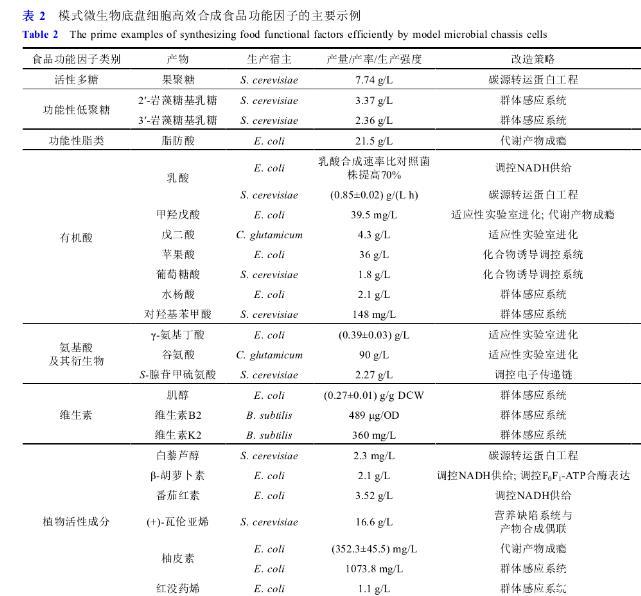
微生物細胞的生長調(diào)控在高效生物制造過程中有舉足輕重的作用,構(gòu)建優(yōu)化模式微生物底盤細胞高效合成食品功能因子已取得一定的進展,幾種功能性低聚糖、多種有機酸、氨基酸、維生素以及植物活性成分等均通過調(diào)控相應(yīng)底盤細胞的生長實現(xiàn)產(chǎn)物有效合成(表2).快速有效地生長和高效地產(chǎn)物合成是微生物底盤細胞的兩個重要特性,但由于細胞資源分配的局限性、異源途徑與細胞代謝競爭導(dǎo)致的代謝通量失衡和代謝異質(zhì)性等問題會嚴重影響微生物細胞工廠的生長特性,進而降低其合成性能.基于合成生物學(xué)原理和技術(shù)已開發(fā)出多種通過調(diào)控細胞生長改善生物合成的策略,通過碳源轉(zhuǎn)運蛋白工程和適應(yīng)性實驗室進化提高底盤細胞的生長速率;通過調(diào)控NADH供給、F0F 1 ATP合酶的表達以及電子傳遞鏈以重編程細胞能量代謝;構(gòu)建營養(yǎng)缺陷系統(tǒng)、開發(fā)基于群體質(zhì)量控制和代謝產(chǎn)物成癮系統(tǒng)使得細胞生長與產(chǎn)物合成偶聯(lián);構(gòu)建化合物誘導(dǎo)調(diào)控系統(tǒng)和群體感應(yīng)系統(tǒng)將細胞生長與產(chǎn)物合成解偶聯(lián),這些策略在優(yōu)化細胞生長的同時可以有效增強產(chǎn)物的合成.而進一步提升細胞生長速率或挖掘具有更好生長潛能的新型微生物宿主,優(yōu)化適應(yīng)性進化方法以及完善動態(tài)調(diào)控工具將更好地促進高效合成食品功能因子細胞工廠的構(gòu)建。
基于微生物的生長調(diào)控高效合成食品功能因子已取得重大進展,但仍然存在一些亟待解決的問題.目前已有多種策略可以有效提高底盤細胞的生長速率,但由于細胞自身的局限和代謝負擔等問題,工程菌株的生長可能會仍低于野生型菌株,阻礙其工業(yè)應(yīng)用.再者,目前研究對象主要局限于模式微生物底盤細胞,因此挖掘生長性能更優(yōu)的微生物對實現(xiàn)產(chǎn)物的高效合成具有重大意義.隨著新的微生物不斷被發(fā)現(xiàn),需要評估其生長代謝能力和產(chǎn)品合成效率.目前,一種快速生長的微生物——需鈉弧菌(Vibrio natriegens)已被分離得到,其倍增時間小于10 min[131]并且相應(yīng)的遺傳操作工具[132~134]也已被開發(fā),因此該菌株作為潛在的微生物合成平臺具有遠大前景,但該菌株作為合成食品功能因子細胞工廠的潛能仍需進一步驗證,因為任何適用于食品合成的微生物底盤細胞的安全性最為重要。
動態(tài)調(diào)控可以有效減弱或避免傳統(tǒng)代謝工程改造策略造成的細胞代謝負擔、中間代謝物或有毒物質(zhì)積累、輔因子失衡和細胞生長受損等問題.但目前開發(fā)的動態(tài)調(diào)控元件數(shù)量不多,且元件響應(yīng)的靈敏性、正交性和穩(wěn)定性仍需進一步優(yōu)化.對此,可利用不同的調(diào)控元件構(gòu)建邏輯線路,高效精細地調(diào)控代謝流;也可通過定向進化優(yōu)化已有元件的響應(yīng)性能,或者挖掘和開發(fā)新型調(diào)控元件.為了進一步擴展細胞生長調(diào)控方法的適用范圍并且避免胞內(nèi)代謝物干擾的問題,Liu團隊[135]引入了基于密碼子擴展的正交翻譯系統(tǒng),該系統(tǒng)可以實現(xiàn)在代謝流調(diào)控和細胞生長關(guān)鍵酶中插入非天然氨基酸(ncAA),并通過精確調(diào)控必需基因的表達來精準控制代謝流量和細胞生長.應(yīng)用該策略,研究人員分別在基因組重編碼的E.coli中將N-乙酰氨基葡萄糖產(chǎn)量提高了4.5倍,在基因組未重編碼的B.subtilis中將燕窩酸產(chǎn)量提高了2.2倍,為創(chuàng)建生長與代謝精準可控的高版本底盤細胞提供了新策略.但該策略仍存在成本較高、難以大規(guī)模應(yīng)用的問題,因此需要進一步優(yōu)化.總之,基于系統(tǒng)生物學(xué)和合成生物學(xué)的代謝工程策略發(fā)展迅速,對微生物的各種機制進行深入挖掘,開發(fā)各種工具調(diào)控細胞生長,為實現(xiàn)食品功能因子的高效、綠色、穩(wěn)定合成提供了潛力。
相關(guān)新聞推薦
1、莠去津?qū)λ靖H土壤微生物菌群結(jié)構(gòu)及降解基因豐度的影響(一)
2、發(fā)根農(nóng)桿菌Ri質(zhì)粒構(gòu)建燈盞花發(fā)根最優(yōu)的培養(yǎng)體系(三)
3、RIP 衍生物對?耐甲氧西林金黃色葡萄球菌生長曲線及生物膜形成的影響(二)
