腸道細菌大腸桿菌與脆弱類桿菌聯合,或能導致結直腸癌癥發生
不少研究者們在近年來已經把目光越來越投向微生物,就像投機的掘金人在深山老林里面游走,期望能夠發現下一座金礦。
確實,人類的身體健康若是只考慮自身的細胞分子的作用,往往還不足以得到讓人信服的答案,尤其是與微生物密切接觸的身高器官組織比如腸道出現疾病,恐怕還得考慮一下微生物在其中有沒有起作用。
結直腸癌(colorectal cancer)可能就是這樣的一種疾病,與腸道中的微生物有關系。
最新一期著名學術期刊《科學》雜志發表了一篇來自約翰霍普金斯大學的重磅研究,他們發現兩種常見的腸道細菌大腸桿菌E.coli(pks+亞型)以及脆弱類桿菌B.fragilis(ETBF亞型)的聯合作用對于遺傳性結直腸癌的發生具有關鍵作用。
結直腸癌高發
據我國國家癌癥中心統計資料顯示,在中國,每年新發癌癥病例達429萬,占全球新發病例的20%,死亡281萬例。癌癥防治已成為我國的重要公共衛生問題。
其中,結腸癌在我國發病率相當高,在男性中僅次于胃癌,排第三位,而在女性中也僅次于肺癌。
在美國亦是如此,結直腸癌具有高發病率以及高死亡率,在美國男性和女性中新增病例均在第三位,而死亡人數在美國男性和女性中也都排在第三位。
結直腸癌與細菌
從遺傳學觀點出發,可將結直腸癌分為遺傳性(家族性)和非遺傳性(散發性)。
前者的典型例子比如家族性腺瘤性息肉病(family adenomatus polyposis,FAP)(約占結直腸癌1%)和家族遺傳性非息肉病結直腸癌(約占結直腸癌5%)。后者主要是由環境因素引起基因突變,當然,即便是散發性結直腸癌,遺傳亦起重要作用。
人類胃腸系統內大約含有1 000種細菌,是人類真核細胞數量的10倍以上,可想而知,探查胃腸道中的疾病若是不考慮一下細菌的的作用,恐怕難以真正知道疾病的背后的原因。
確實,結直腸癌與細菌的關系一直是關注的焦點,目前也有一定的研究顯示,與健康對照組相比,結直腸癌患者的糞便梭桿菌、腸球菌科、彎曲桿菌、柯林斯菌屬和消化鏈球菌明顯增多,而梭狀芽孢桿菌Ⅳ組的成員如柔嫩梭菌屬和羅氏菌屬則消耗殆盡。在腸黏膜中,結直腸癌患者的卟啉單胞菌屬、梭桿菌和消化鏈球菌增加,而柔嫩梭菌屬和雙歧桿菌被耗盡。與結直腸癌相關的菌群則富集了促炎機會致病菌,如梭桿菌、腸球菌科和彎曲桿菌屬等。這些結果均提示,腸道菌群種類和數目的變化在結直腸癌的發生和發展中具有重要作用。
然而,究竟這些細菌在結直腸癌的發生在具有怎樣的作用,是輔助作用還是起主導作用?這其中的分子機制需要進一步探明。
這篇研究
由約翰霍普金斯大學大學Cynthia L.Sears教授領導的這篇研究以家族性腺瘤性息肉病(family adenomatus polyposis,FAP)(約占結直腸癌1%)為研究對象,來闡述細菌對其發生發展的機制。
FAP患者十幾歲時開始出現腺瘤,如果不治療,到40歲時絕大多數的患者會轉變為結直腸癌。然而,這到底是什么原因引起的呢?換句話說,本來FAP并不致命,雖然也是瘤子,但是是良性的,不致命,結果隨著時間的延長,漸漸發展成為結直腸癌,這是什么原因導致的呢?研究者們一直沒有搞清楚。
Cynthia L.Sears教授領導的團隊決定從微生物的角度入手來探查一番。在FAP患者的腸道表面有一層厚厚的由微生物組成的膜,又叫做細菌生物膜(bacteria biofilm),是由細菌在腸道表面逐漸附著、增殖而成,成分也較為復雜。
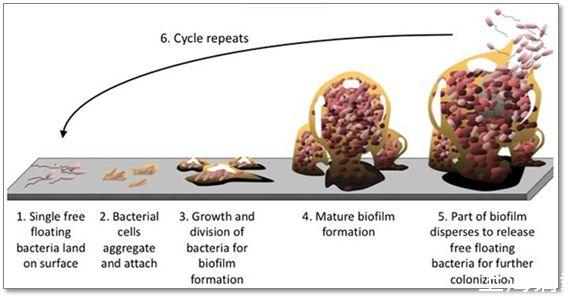
▲這張圖顯示了細菌生物膜的形成過程
這層厚厚的細菌生物膜會不會與FAP轉變成結直腸癌相關呢?
研究者們首先發現,FAP患者的這層厚厚的細菌生物膜中的細菌主要由兩種細菌構成,一種是大腸桿菌E.coli,一種是脆弱類桿菌B.fragilis。
研究者們進一步研究之后,發現大腸桿菌E.coli的亞型pks+E.coli和脆弱類桿菌B.fragilis的亞型ETBF是主要的菌株。
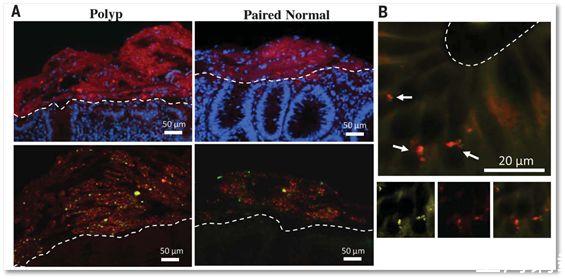
▲這張圖中A小圖上面一排顯示FAP患者息肉上面的細菌生物膜(Polyp)和正常腸道組織上面的細菌生物膜對比,前者厚度明顯大于后者(圖中紅色的部分,白線以上為菌膜);圖中A小圖下面一排則顯示,菌膜的主要組成細菌是E.coli和B.fragilis(圖中紅色表示E.coli,綠色表示B.fragilis);B圖則表明細菌已經侵入到FAP患者的正常腸道組織中去了(白線以下為腸道組織細胞,箭頭顯示的是細菌)
E.coli至少可分成A、B1、B2、D4個亞型,其中B2亞型攜帶一種保守的基因島-“聚酮合成酶(polyketide synthase,pks)島”,可產生一種多聚乙酰一肽的基因毒性物質(colibactin),其可以導致DNA損傷,造成癌變的發生。
脆弱類桿菌(B.fragilis)是正常人和動物結腸區域的厭氧菌,而ETBF是B.fragilis的一種亞型,感染后可無癥狀定植于人體內,也可引起腹瀉等疾病,曾有小鼠實驗表明ETBF可引起結腸炎性反應,并顯著增加多發性腸道腫瘤小鼠模型中結腸腫瘤的發生率。
在FAP的人群中60%以上的人都具有pks+E.coli和ETBF,而正常人則只有20-30%的人含有這兩種細菌。因此,研究者們有理由懷疑pks+E.coli和ETBF與FAP由良性向惡性的結直腸癌轉變有關。
進一步研究
僅僅懷疑這兩個細菌亞型是沒有什么意思的,必須要拿出證據來說明一下。
因此,這又到了科學家們最常干的事情之一了,你說這兩個細菌pks+E.coli和ETBF能夠造成腫瘤,那我們就在小老鼠身上試一試,把這個細菌喂給小老鼠吃一吃,然后觀察它們得沒得腫瘤不就行了嗎?
確實,研究者們也不必你高明多少,它們就是這么干的!
結果如何呢?
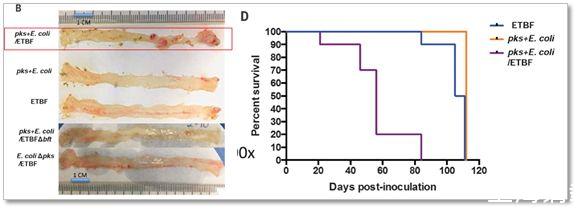
▲這張圖中左邊的B小圖顯示在pks+E.coli和ETBF處理的各種情況下小鼠的腸道中的腫瘤情況,其中紅線框中這一組顯示pks+E.coli和ETBF聯合處理能夠讓小鼠腸道長腫瘤(圖中血色的凸起物為腫瘤),其他處理組則幾乎沒有腫瘤;右邊的D小圖顯示pks+E.coli和ETBF聯合處理大幅降低小鼠的生存率(圖中紫色線條)
結果顯示,pks+E.coli和ETBF聯合處理能夠讓小鼠腸道長腫瘤,并且大幅降低小鼠的生存率,而單獨使用pks+E.coli或者ETBF則對小鼠沒有太大的影響,這說明只有pks+E.coli和ETBF這兩種細菌在一起才能夠促使結直腸癌的形成。
原因是什么
確實,科學家之所以區別于常人,正是因為需要問一個“why”,為啥pks+E.coli和ETBF這兩種細菌在一起就能夠促使結直腸癌的形成呢?
研究者們繼續深入探討,一方面發現白介素17(IL-17)在這其中扮演著關鍵角色,因為,IL-17誘發了大量的炎癥反應;另一方面發現,ETBF這種細菌能夠有效地幫助pks+E.coli這種細菌定殖(colonization),這樣一來,pks+E.coli越來越多,前面也說了,pks+E.coli會產生基因毒性物質(colibactin),其可以導致DNA損傷,造成癌變的發生,因此,越來越多的有毒物質colibactin就會對DNA造成更大的損傷,從而造成腫瘤。
然而,僅僅有上面的解釋還不夠,分子機制是什么呢?尤其是細菌BTBF是怎么幫助pks+E.coli定殖到腸道表面的呢?還有這個IL-17是怎么來的呢?恐怕還會有更加復雜因素。
確實,這支約翰霍普金斯大學的研究者們在最新出版的另一權威雜志《Cell Host&Microbe》上面發表的相關文章進一步揭示了相關的分子機制。
那么,研究者們發現的是什么機制呢?
主要是首先,BTBF細菌產生一種毒素,叫做BFT(Bacteroides fragilis toxin,BFT),這是一種依賴鋅的金屬蛋白,這種毒素可以激活Wnt/bcatenin通路以及NF-kB通路;這些通路一激活,就導致了大量的IL-17的產生,而IL-17就會和它的受體IL-17R結合,這就進一步激活了NF-kB通路NF-kB通路、STAT3,進而促使CXCL1等產生;CXCL1等產生之后就會招募大量的MDSC(Myeloid-derived suppressor cells,MDSCs)細胞。
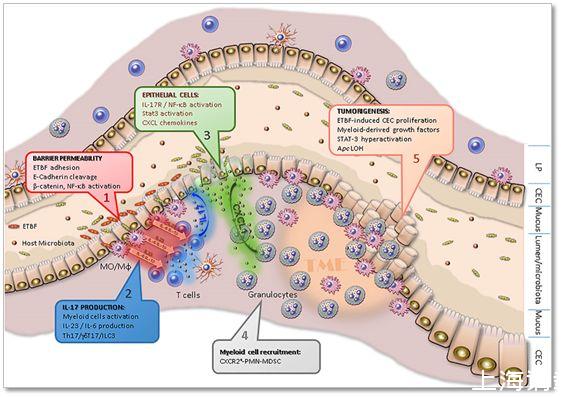
▲BTBF細菌誘導腫瘤發生的分子機制模式圖
眾所周知,MDSC細胞在腫瘤中起免疫抑制,促進腫瘤發生、侵襲轉移和血管生成等作用。
因此,研究者們通過一篇《Science》和一篇《Cell》子刊,共兩篇文章深入揭示了兩種導致結直腸癌的細菌pks+E.coli和ETBF及其分子機制。為開發相關的腫瘤治療方案提供了依據。
相關新聞推薦
2、不同濃度的檸檬酸鈉對脫氮假單胞桿菌發酵過程的影響——摘要、結論與討論
