土霉素菌渣無害化處理:篩選菌株的生長曲線及產蛋白酶條件(一)
土霉素菌渣是龜裂鏈霉菌(Streptomycesrimosus)發酵生產土霉素過程中產生的酸性固態廢棄物,是在土霉素提取過程中,加入草酸等試劑酸化過濾后產生的,因此呈酸性,主要含有土霉素生產發酵培養基成分、生產用菌體和產品分離、提純所用的試劑以及殘留的土霉素等。2008年抗生素菌渣列入《國家危險廢物名錄》,禁止用作飼料或飼料添加劑。土霉素菌渣含水量高、熱值低,在烘干和焚燒過程中需要大量的外部熱量和燃料,因此其處置成本較高。我國雖沒有明文規定抗生素菌渣不能作為肥料使用,但其存在菌渣處理不完全、制備的有機肥可能含有的抗生素殘留或代謝中間產物,在生物體內累積,產生抗藥性等潛在的生態風險。如何在環境友好、安全的前提下,合理有效地利用菌渣是目前亟待解決的重要課題。
本研究通過篩選能夠耐受土霉素菌渣并能產生蛋白質酶的菌株,旨在利用該菌株對土霉素菌渣進行發酵處理,充分利用菌渣成分,獲得可再利用的發酵液,作為培養基成分重新利用于土霉素生產中,在節省資源的同時,達到菌渣的無害化處理目的。
1材料與方法
1.1材料
1.1.1樣品
土霉素菌渣和土霉素菌渣堆肥,均由內蒙古華曙生物科技有限公司提供。
1.1.2試劑與儀器
土霉素標準品(HPLC≥95%),;蔗糖、賴氨酸、Folin-酚試劑、茚三酮、重鉻酸鉀等試劑均為國產分析純。TU-1901紫外分光光度計;TGL-16K高速冷凍離心機;霉菌培養箱MJ-16085-III,;ZHWY2102C立式雙層恒溫搖床。
1.2方法
1.2.1培養基的配制
5%菌渣培養基:稱取干燥的400目土霉素菌渣粉末5 g加到100 mL自來水中混勻,pH值自然,用高壓滅菌鍋滅菌121℃,20 min,備用。配制5%的菌渣固體培養基需要加入5 g瓊脂以確保凝固性。
10%菌渣培養基:稱取干燥的400目土霉素菌渣粉末10 g加到100 mL自來水中混勻,pH值自然,用高壓滅菌鍋滅菌121℃,20 min,備用。
察氏液體培養基:硝酸鈉3 g、磷酸氫二鉀1 g、七水硫酸鎂0.5 g、氯化鉀0.5 g、硫酸亞鐵0.01 g、蔗糖30 g、水1 000 mL。121℃,20 min滅菌備用。固體察氏培養基添加2%的瓊脂。
1.2.2菌株的篩選
用無菌水浸泡土霉素菌渣堆肥樣品,得到的浸出液在察氏培養基平板上進行涂布,30℃下培養,獲得菌落。
將察氏培養基上生長出的不同單菌落,分別在5%菌渣固體培養基上劃線接種,在30℃條件下培養,分別獲得M-1、M-2的單一菌落。
1.2.3篩選菌株的生長曲線
制備孢子懸液:分別選擇在察氏培養基上長勢良好且孢子旺盛的M-1、M-2菌株,分別刮取孢子,用無菌水制成2.0×106個/mL的M-1和M-2的孢子懸液。
在裝有100 mL察氏培養基的250 mL錐形瓶中,分別接入1 mL的M-1、M-2孢子懸液。每種菌做3組平行,每組13瓶。30℃、160 r/min搖床上培養。每隔12 h取出6瓶,5 000 r/min離心10 min,稱量菌絲濕重,繪制生長曲線。
1.2.4篩選菌株的酸、堿耐受性
分別配制pH值為2、3、4.5、6.5、7、8的100 mL/250 mL察氏培養基。分別接入1 mL的M-1、M-2的孢子懸液,每個梯度平行做3組,在30℃,160 r/min條件下培養6 d。5 000 r/min離心10 min,稱量菌絲濕重,考察菌株的土霉素耐受性。
1.2.5篩選菌株的土霉素耐受性
配制含有土霉素0、200、600、1 000、1 400和1 800 u/mL,pH 3的察氏液體培養基各100 mL,分別加入250 mL錐形瓶中。吸取1 mL的M-1、M-2的孢子懸液接入不同土霉素含量的察氏液體培養基中,在30℃,160 r/min條件下培養6 d。用5 000 r/min離心10 min,獲得濕菌絲,稱重,分析并比較土霉素對菌體生長的影響,考察其土霉素耐受性。
1.2.6菌株產蛋白酶條件的優化
(1)菌株產蛋白酶活力的測定。以酪氨酸為標準物,Folin-酚試劑為顯色劑,在660 nm處測定吸光值,繪制酪氨酸標準曲線,其回歸方程式為y=127.22x-1.948 8,R2=0.997 4。
取一支試管,加入1 mL酪蛋白溶液(2%,pH 6.5磷酸鹽緩沖液配制),置入40℃水浴中預熱5 min,再加入1 mL 40℃預熱5 min的樣品溶液,混勻后在40℃水浴中保溫10 min。立刻加入2 mL 0.4 mol/L三氯乙酸,搖勻,保溫20 min。離心,吸取上清液1 mL,加入5 mL的0.5 mol/L碳酸鈉溶液,最后加入1 mL Folin-酚試劑,于40℃水浴中顯色20 min。在660 nm波長下測吸光度。
酶活定義為在40℃,pH 6.5條件下,每分鐘水解酪蛋白產生1 mg酪氨酸所需的酶量為1個酶活力單位(u)。
(2)菌株產蛋白酶條件的優化。為了優化產酶條件,以蛋白酶活力為依據,在察氏培養基中,對培養溫度、pH值和培養時間進行研究。在菌渣培養基中,對菌渣添加量、接種量和裝液量等因素進行研究。
1.2.7篩選菌株對土霉素菌渣的轉化
(1)菌渣整體質量的變化。在含有100 mL 5%菌渣液體培養基的250 mL錐形瓶中,分別加入8 mL的M-1、M-2的孢子懸液和無菌水,平行3組。在30℃、160 r/min條件下培養7 d。取出后在5 000 r/min條件下離心10 min,收集沉淀物。沉淀物在105℃條件下烘干至恒重,冷卻后精確稱量其重量。
(2)菌渣蛋白質含量的變化。培養方法同上。取出后在5 000 r/min條件下離心10 min,收集沉淀物。沉淀物在105℃條件下烘干至恒重,用凱式定氮法測定其蛋白含量。
(3)菌渣的游離氨基酸變化影響。培養方法同上。取出后在5 000 r/min條件下離心10 min,收集上清液,定容至一定體積,并測定其游離氨基酸含量。游離氨基酸的測定,以賴氨酸標準物,茚三酮為顯色劑,在565 nm波長處測吸光值,得到回歸方程式為y=304.74x+7.299 1,R2=0.999 1。
2結果與分析
2.1菌株的篩選
分離純化獲得兩種霉菌,分別命名為M-1和M-2,菌落形態如下圖。經初步鑒定M-1為米曲霉、M-2為綠色木霉。
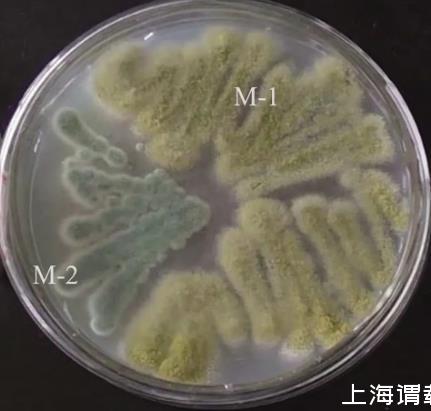
圖1篩選菌株菌落形態
2.2篩選菌株的生長曲線
將篩選菌株接種到液體察氏培養基中,培養一定時間后分別取樣測定菌絲濕重,以菌絲濕重值為縱坐標,培養時間為橫坐標,繪制生長曲線。由圖2可見,培養開始24 h后,兩種菌株的菌絲重量均急劇上升,此時菌種進入快速增長期。在72 h時,菌株M-1到達增長高點,隨后菌絲濕重無明顯變化,進入緩慢衰亡期;而菌株M-2在108 h時菌絲濕重達增長高點,隨后進入衰亡期。
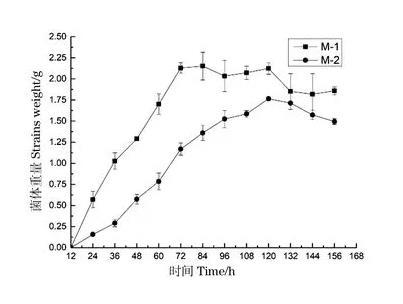
圖2篩選菌株生長曲線
2.3篩選菌株的酸、堿耐受性
由圖3可知,M-1和M-2分別在pH 3和pH 6.5表現出最佳的生長量,均呈現出良好的耐酸性。M-1耐酸性好于M-2。兩種菌對堿性環境耐受性較差。
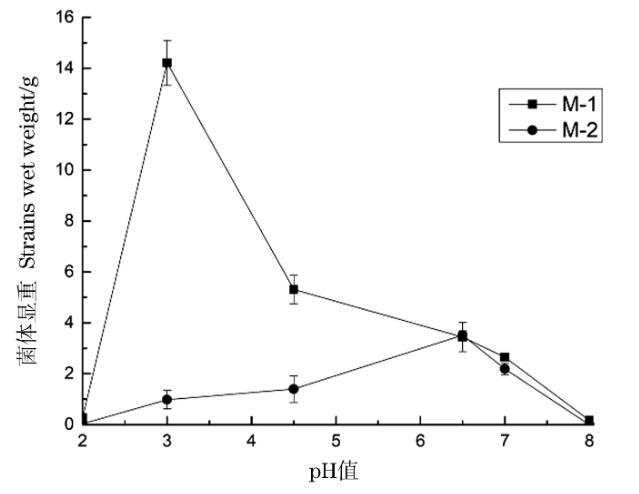
圖3 pH值對菌體生長的影響
土霉素菌渣的pH在3.35到3.77之間呈酸性。兩種霉菌都可以在樣品的pH范圍內生長,滿足了處理土霉素菌渣的必要條件。
2.4篩選菌株的土霉素耐受性
從圖4可知,M-1土霉素耐受性好于M-2。土霉素濃度低于1 800 u/mL時,對兩種霉菌的影響有限,兩株霉菌可以在較高濃度的土霉素環境下均生長良好。菌渣里土霉素殘留在416.6 u/mL左右,遠低于1 800 u/mL的土霉素濃度,所以兩種菌株在處理土霉素菌渣時,不會被土霉素抑制繼而影響處理效率。
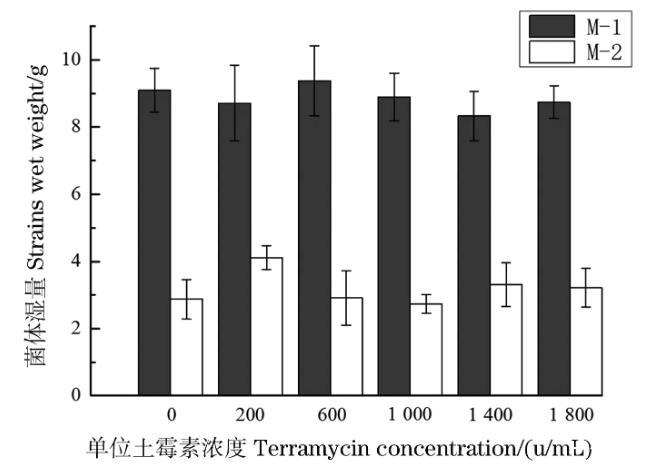
圖4土霉素濃度的變化對菌體生長的影響
2.5菌株產蛋白酶條件的優化
2.5.1培養基初始pH對菌株產蛋白酶能力的影響
向100 mL/250 mL察氏培養基中,分別接入1 mL M-1、M-2孢子懸液,初始pH值分別設定為5.5、6、6.5、7、7.5、8、8.5,平行3組,在30℃,轉速為160 r/min條件下培養168 h,分別取樣測定酶活,考察pH值變化對產酶活性的影響,結果如圖5。
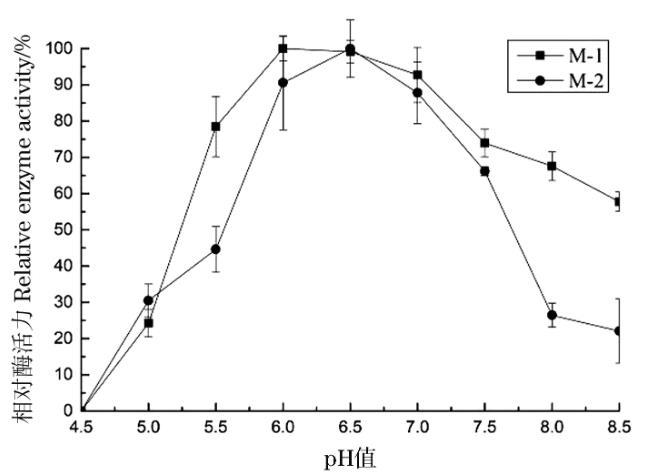
圖5初始pH對菌株產酶的影響
培養基初始pH值小于6.0時,菌株M-1和M-2均隨著pH值的增大其產蛋白酶活力快速增加,pH值大于7.0時,隨著pH值的增大其酶活力快速下降;菌株M-1在pH 6.0時,蛋白酶活力達到最高值,菌株M-1在pH6.5時其酶活達到最高。因此,菌株M-1和M-2產蛋白酶的最適初始pH值分別確定為6.0和6.5。
土霉素菌渣無害化處理:篩選菌株的生長曲線及產蛋白酶條件(一)
土霉素菌渣無害化處理:篩選菌株的生長曲線及產蛋白酶條件(二)
相關新聞推薦
3、食品接觸表面的微生物污染長期存在,如何篩選出代表性抗菌化合物的消毒劑
